Связь иммуноопосредованных побочных реакций с эффективностью ниволумаба при лечении немелкоклеточного рака легких
Актуальность
Развитие иммунотерапии позволило улучшить результаты лечения различных типов рака, включая немелкоклеточный рак легкого (НМРЛ). Ниволумаб, пембролизумаб и другие моноклональные антитела к PD-1 были одобрены для лечения метастатического НМРЛ на основе недавних клинических исследований, демонстрирующих увеличение выживаемости по сравнению с цитостатической химиотерапией1-4. Однако, лечение иммунными checkpoint-ингибиторами сопровождается иммуноопосредованными побочными реакциями5,6. Было установлено, что развитие ИПР связано с повышением выживаемости больных меланомой7-11, поэтому можно предположить, что раннее возникновение ИПР является прогнозом лучшего результата лечения иммунными checkpoint-ингибиторами. При контроле над этими реакциями будет возможность получить максимальный терапевтический эффект данных препаратов. И все же, связь между возникновением ИПР и эффектом такого лечения пациентов с НМРЛ остается недоказанной.
Материалы и методы
Было проведено мультицентровое ретроспективное исследование для изучения уровня ИПР и их связи с клиническим применением ниволумаба при НМРЛ. В данном исследовании все 134 пациента были с прогрессирующим или рецидивирующим НМРЛ и получали лечение ниволумабом в качестве второй линии или последующих линиях, в период с декабря 2015 года по август 2016 года. В группу были включены пациенты с наличием или отсутствием иммуноопосредованных побочных реакций. ИПР были распределены в зависимости от вида и степени. Все данные были получены при обзоре медицинской документации нескольких учреждений: клиническая больница и муниципальные медицинские учреждения. Данные актуальны по состоянию на 31 декабря 2016 года.
Результаты
Общая частота ответа была значительно выше у пациентов с ИПР, чем у тех, у кого они отсутствовали (23 из 44 пациентов [52,3%] против 17 из 61 пациента [27,9%]; P = .02).
Развитие ИПР было значительно связано с увеличением выживаемости без прогрессирования (P = 0,04) и общей выживаемости (P = 0,01). Безрецидивная выживаемость составляла 9,2 месяца (95% ДИ, 4,4 - ?) и 4,8 месяца (95% ДИ, от 3,0 до 7,5) (P = 0,04), тогда как медиана общей выживаемости была не достигнута (95 % ДИ, 12,3 - ?) и 11,1 месяца (95% ДИ, 9,6 - ?) (P = 0,01) для пациентов с или без ИПР соответственно.
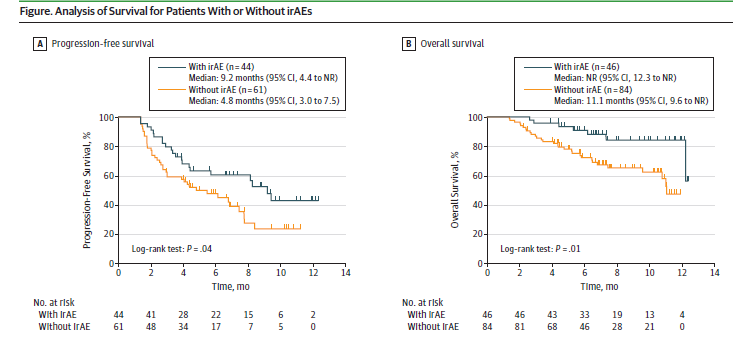
Рисунок 1 - Безрецидивная и общая выживаемостс пациентов с наличием или отсутствием ИПР. irAE – иммуноопосредованные побочные реакции.
Связь ИПР с эффективностью ниволумаба была дополнительно подтверждена многофакторным анализом. Многофакторный анализ показал, что дерматологические и любые другие ИПР были значительно связаны с увеличением безрецидивной и общей выживаемости, тогда как при эндокринных ИПР связи не наблюдалось, возможно, из-за небольшого числа пациентов с эндокринной ИПР и недостаточного времени наблюдения общей выживаемости.
Учитывая, что данные были получены из нескольких учреждений, включая объединенные больницы, выводы исследователей могут быть применимы к общей популяции НМРЛ.
Заключение
Результаты данного исследования показали, что ИПР, связанные с применением ниволумаба, повышают эффективность лечения у пациентов с НМРЛ. Проведенное исследование является первым, в котором выявилась связь возникновения ИПР с эффективностью ингибиторов PD-1 при НМРЛ. Но с учетом ретроспективного характера исследования, недостаточного времени для изучения результата долгосрочной выживаемости, небольшого размера выборки с редкими, не считая дерматологических, иммуноопосредованными побочными реакциями, не удалось оценить наиболее зависимый вид ИПР от проведенного лечения. Поэтому для уточнения и более точного подтверждения сделанных выводов необходимы дальнейшие исследования с большим числом пациентов.
Источник: https://jamanetwork.com/journals/jamaoncology
Литература:
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med. 2015;373(17):1627-1639.
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med. 2015;373 (2):123-135.
- Herbst RS, Baas P, Kim D-W, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-celllung cancer (KEYNOTE-010): a randomised controlled trial. Lancet. 2016;387(10027):1540-1550.
- Reck M, Rodríguez-Abreu D, Robinson AG, et al; KEYNOTE-024 Investigators. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med. 2016;375 (19):1823-1833.
- Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination. Nat Rev Clin Oncol. 2016;13(8):473-486.
- Friedman CF, Proverbs-Singh TA, PostowMA. Treatment of the immune-related adverse effects of immune checkpoint inhibitors: a review. JAMA Oncol. 2016;2(10):1346-1353.
- SanlorenzoM, Vujic I, Daud A, et al. Pembrolizumab cutaneous adverse events and their association with disease progression. JAMA Dermatol. 2015;151(11):1206-1212.
- Nakamura Y, Tanaka R, Asami Y, et al. Correlation between vitiligo occurrence and clinical benefit in advanced melanoma patients treated with nivolumab: A multi-institutional retrospective study. J Dermatol. 2016;44(2):117-122.
- Hua C, Boussemart L, Mateus C, et al. Association of vitiligo with tumor response in patients with metastatic melanoma treated with pembrolizumab. JAMA Dermatol. 2016;152(1):45-51.
- Freeman-Keller M, Kim Y, Cronin H, Richards A, Gibney G,Weber JS. Nivolumab in resected and unresectable metastatic melanoma: characteristics of immune-related adverse events and association with outcomes. Clin Cancer Res. 2016;22(4):886-894.
- Teulings HE, Limpens J, Jansen SN, et al. Vitiligo-like depigmentation in patients with stage III-IV melanoma receiving immunotherapy and its association with survival: a systematic review and meta-analysis. J Clin Oncol. 2015;33(7):773-781.
- Weber JS, Hodi FS,Wolchok JD, et al. Safety profile of nivolumab monotherapy: a pooled analysis of patients with advanced melanoma. J Clin Oncol. 2017;35(7):785-792.
- Osorio JC, Ni A, Chaft JE, et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small cell lung cancer. Ann Oncol. 2016.
- Hasan Ali O, Diem S, Markert E, et al.Characterization of nivolumab-associated skin reactions in patients with metastatic non-small celllung cancer. Oncoimmunology. 2016;5(11):e1231292
Материал подготовлен НОИМТОиР : клинический ординатор Лопаева Ю.В.
