Stimul.online
Биобанкинг для антираковой вакцины
31 января 2023
Фундаментом наук о жизни на современном этапе их развития стали биобанки. Например, ученые Национального медицинского исследовательского центра онкологии имени Н. Н. Петрова, создавшие технологию получения индивидуальных клеточных вакцин против рака, не смогли бы сделать этого, не имея банка биологического материала однотипно пролеченных онкологических пациентов
На рубеже тысячелетия в науках о жизни сформировалось своеобразное игольное ушко. На входе в него встретились разнообразные биологические коллекции и современные технологии хранения биологических образцов, позволяющие не только изучать эти образцы, но и использовать их в прикладных работах по созданию новых лекарств, вакцин, технологий лечения. В число принципиально важных параметров хранения вошел жидкий азот с температурой минус 195 градусов Цельсия, при которой все жизненные процессы в живой клетке останавливаются, но она может быть восстановлена в нужный ученому момент. На выходе — современные методы лечения, передовые медицинские технологии.
На современном этапе развития наук о жизни биобанки стали их фундаментом, хотя процесс формирования подобных банков в разных странах находится на разных стадиях. Так, ученые Национального медицинского исследовательского центра онкологии имени Н. Н. Петрова, не имея собственного биобанка, не смогли бы создать технологию получения индивидуальных клеточных вакцин против рака.

Исполнительный директор Национальной ассоциации биобанков и специалистов по биобанкированию (НАСБИО) Артем Муравьев
КУНСТКАМЕРЫ И ГЕРБАРИИ ОСТАЮТСЯ В ПРОШЛОМ
«Движение биобанкинга как таковое началось 30‒35 лет назад, — рассказал “Стимулу” Артем Муравьев, исполнительный директор Национальной ассоциации биобанков и специалистов по биобанкированию (НАСБИО), объединяющей на сегодня 74 организации и индивидуальных членов. — К 1999 году накопилась критическая масса и было создано Международное общество биологических репозиториев и репозиториев окружающей среды (ISBER). Это была поворотная веха в переходе от создания биологических коллекций к биобанкированию».
Коллекции живых организмов и их частей создавали уже триста лет назад и даже раньше. В Европе были распространены кунсткамеры с заспиртованными образцами живых организмов, ученые собирали и изучали гербарии, коллекционировали и изучали насекомых. После того как были изобретены чашка Петри и технология культивирования микроорганизмов, стали появляться коллекции микробов. Но все эти собрания не в полной мере соответствуют понятию «биобанк». Оно подразумевает структурирование методов хранения образцов, стандартизацию процесса их сбора, хранения и использования. По словам Артема Муравьева, первый сборник рекомендаций по биобанкированию Международное общество биологических репозиториев и репозиториев окружающей среды выпустило в 2005 году. Рекомендации регулярно дополнялись, уточнялись, система биобанкирования развивалась и совершенствовалась, и сейчас действует уже четвертая версия рекомендаций.
Именно строгость правил хранения и учета образцов и применение современных технологий при создании биобанков привели к тому, что многие коллекции так и остались коллекциями. «Некоторые вещи уже невозможно поменять. Сейчас стандарт сбора, обработки и хранения биоматериала очень высокий. Эти стандарты развиваются и усложняются. Старые коллекции никуда не делись, но их сложно использовать в текущей действительности», — пояснил Артем Муравьев.
«Движение биобанкинга как таковое началось 30‒35 лет назад. К 1999 году накопилась критическая масса и было создано Международное общество биологических репозиториев и репозиториев окружающей среды (ISBER). Это была поворотная веха в переходе от создания биологических коллекций к биобанкированию»
Лидерами в сфере создания и использования биобанков он назвал Японию, Великобританию, Германию, США. Россия, по мнению эксперта, отстает от лидеров лет на 10‒15, Африка и Латинская Америка остаются белыми пятнами.
Много биобанков создано в Китае, но о них очень мало открытой информации. Британский биобанк, напротив, ведет очень открытую политику, разрешая использовать свои материалы для научных исследований, скрывая для пользователей персональную информацию. В результате на материале британского биобанка подготовлено огромное число научных публикаций. Возможно, именно это и породило мем про британских ученых, которые все на свете открыли и выяснили.
Отличительной чертой процесса биобанкирования стала ориентация биобанков на фарминдустрию, то есть на прикладные исследования, в отличие от фундаментальных, ради которых веками собирали коллекции биологических образцов.
Одним из первых в России стал биобанк образцов биологического материала онкобольных, который создали 24 года назад в НИИ онкологии имени Н. Н. Петрова (сейчас Национальный медицинский исследовательский центр онкологии имени Н. Н. Петрова Минздрава России). «Наш биобанк содержит образцы биологического материала однотипно пролеченных онкологических пациентов. Мы занимаемся биобанкированием, биоаналитикой, хранением опухолевых клеточных культур и клеточных линий, клеток иммунной системы, продуктов исследовательского назначения, аннотированим образцов, депонированием и патентованием уникальных опухолевых клеточных линий, — рассказала “Стимулу” онкоиммунолог, кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии НМИЦ онкологии имени Н. Н. Петрова Татьяна Нехаева. — В составе биобанка работает высокотехнологичная лаборатория, которая обеспечивает обработку и анализ биоматериалов. Здесь в короткий срок создают клеточные 2D- и 3D-модели для доклинических и клинических исследований, ведут разработки новых технологий, изучают взаимодействия клеток иммунной системы с различными типами опухолей человека и лабораторных животных».
К созданию биобанка ученых подтолкнула необходимость изучить агрессивные опухоли и их метастазы, клоногенность (способность клеточной культуры генерировать разное число клон-инициирующих клеток на единицу объема) опухоли, которая не отвечала на стандартное лечение, уклонение ряда опухолей от иммунного надзора. Ученые погрузились в изучение клеток иммунной системы и их взаимодействия с различными типами опухолей. Параллельно началась разработка аутологичных (собственных) и аллогенных (относящихся к другой особи) противоопухолевых вакцин, в том числе генно-модифицированных, о чем уже писал «Стимул». Наработки быстро внедряли в клиническую работу с пациентами, которым было невозможно помочь другими методами.
«Требования к обработке, качеству и полноте характеристик биообразцов, к этичности их сбора и использования и сама концепция биобанка формировались постепенно, — говорит Татьяна Нехаева. — Два десятилетия назад в России не было банков биологического материала однотипно пролеченных онкологических пациентов».
Финансовой основой для этой работы стали государственные задания Министерства здравоохранения РФ и гранты российских научных фондов.
«У онкологических больных баланс между иммуногенностью (способностью вызывать реакцию иммунитета) и иммуносупрессией (подавление иммунитета) считается ключевым фактором эффективности иммунотерапии. Положительный баланс формирует низкая иммуносупрессия и отрицательный баланс — высокая иммуносупрессия»
Национальная ассоциация биобанков и специалистов по биобанкированию была создана в России в 2018 году, тогда же на русский язык впервые были переведены и изданы в России рекомендации ISBER. НАСБИО поставила своей целью внедрение современных мировых стандартов биобанкирования в целях повышения качества российских научно-медицинских исследований. Биобанк НМИЦ онкологии им. Н. Н. Петрова вступил в НАСБИО в 2019 году. Одновременно с работой в составе НАСБИО биобанк НМИЦ онкологии взаимодействует с авторитетными организациями в своей сфере. «В онкологии ведущая роль во взаимодействии принадлежит Биобанку рака человека Национального института рака США (The Cancer Human Biobank, National Cancer Institute) и Конфедерации онкологических биобанков Национального института исследования рака Великобритании (National Cancer Research Institute Confederation of Cancer Biobanks, NCRI CCB)», — уточнила Татьяна Нехаева.

Онкоиммунолог, кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии НМИЦ онкологии имени Н. Н. Петрова Татьяна Нехаева
КАК РАБОТАЕТ БИОБАНК
В Биобанке НМИЦ онкологии им. Н. Н. Петрова собирают, обрабатывают и хранят разные виды биообразцов. Это культуры опухолевых клеток человека (первичной опухоли и метастазов), стромальные клетки опухоли (внутриопухолевые фибробласты, инфильтрирующие опухоль лимфоциты), мононуклеары (клетки иммунной системы) костного мозга и периферической крови, сыворотка и плазма периферической крови, образцы асцитической и плевральной жидкости, супернатанты клеточных культур (образцы питательной среды, в которой живут опухолевые клетки и секретируют различные цитокины — биологически активные вещества). Их забирают и криоконсервируют на каждом пятом пассаже (пассаж — интервал между повторным пересевом клеток). Все виды материалов имеют четкую связь с историей болезни пациента.
«Разнообразный набор образцов позволяет изучить опухолевое микроокружение, которое состоит из различных клеток, например из клеток, которые формируют сосуды и питают опухоль, клеток иммунной системы, — комментирует Татьяна Нехаева. — Их постоянное динамическое взаимодействие с клетками растущей опухолевой массы происходит через продукцию разнообразных молекул — цитокинов, ростовых факторов, гормонов, секретируемых клеточными культурами в среду для их роста. Эти молекулы могут блокировать работу иммунных клеток и способствовать росту опухоли. Исследуя клетки, которые окружают опухоль, специалисты прогнозируют возможный ответ пациента на лечение, дальнейшее течение и исход болезни. У онкологических больных баланс между иммуногенностью (способностью вызывать реакцию иммунитета) и иммуносупрессией (подавление иммунитета) считается ключевым фактором эффективности иммунотерапии. Положительный баланс формирует низкая иммуносупрессия и отрицательный баланс — высокая иммуносупрессия».
Иммуносупрессию вызывают опухолевые клетки, то есть сама опухоль, а также некоторые методы лечения — химиотерапия, радиотерапия, которую пациенты получают в рамках стандартного лечения.
Биообразцы клеточных культур опухолей, полученные из операционного материала пациентов, хранятся в биобанке в течение долгого времени. Каждые три‒пять лет необходимо их размораживать подсчитывать количество и определять жизнеспособность клеток, культивировать их и снова закладывать на хранение. Первые клеточные культуры были получены из образцов меланомы кожи, рака почки, колоректального рака. Далее добавились разные виды сарком мягких тканей, остеогенные саркомы, рак мочевого пузыря, рак молочной железы, глиобластомы. Клеточные линии глиобластомы появились в 2021 году, с их помощью в НМИЦ онкологии уже лечатся первые двадцать пять пациентов с этим грозным диагнозом.
Опухолевые клеточные культуры делят по происхождению на полученные из первичной опухоли, метастазов, рецидива. Это позволяет ученым изучать изменчивость и устойчивость клеток опухоли под воздействием различных методов — химиотерапии, лучевой, таргетной, иммунотерапии.
Некоторые типы биообразцов (плазма, сыворотка, супернатанты клеток опухоли, дендритные клетки) не могут быть повторно заморожены.
Для контроля и учета сведения о биообразцах регулярно вносят в единую электронную базу. По истечению сроков хранения биообразцы утилизируют.
Опухоль состоит из клеток с разными молекулярно-биологическими свойствами, которые формируют ее особый профиль, уникальный для каждого пациента. В процессе прогрессирования заболевания или под воздействием предшествующего лечения опухолевые клетки постоянно изменяются, что позволяет им избегать иммунного надзора
Биобанк в НИИ онкологии имени Н. Н. Петрова в 1990-е годы начинался с коллекции образцов. «В самом начале работы мы использовали образцы опухоли индивидуально для каждого больного. Это требовало времени для наращивания опухолевой клеточной массы и изготовления единичных вакцин, — рассказывает Татьяна Нехаева. — Метастатический опухолевый процесс требовал более интенсивного лечения, и мы поняли, что без создания биобанка не сможем достичь поставленных целей, остановить развитие опухоли у пациента и запустить процесс ее самоуничтожения. Мы четко понимали, что различные направления нашей деятельности, а именно производство “живых” персонализированных клеточных препаратов, изучение иммуносупрессии, активация специфического противоопухолевого иммунного ответа, изучение опухолевого микроокружения развиваются намного эффективнее, если у нас есть охарактеризованный биоматериал в нужном объеме и хорошего качества, с которым можно планировать сложные проекты».
Интенсифицировать исследования помогало современное оборудование. В 2013 году для работы с образцами биобанка был закуплен проточный лазерный анализатор для проведения многокомпонентного иммунохимического анализа секреции цитокинов клетками иммунной системы и опухолевыми клетками. Этот метод позволяет проанализировать десятки образцов одновременно и в каждом образце изучить 40 параметров, а то и больше. Количество научного материала резко выросло, его обработка ускорилась, научные результаты стали появляться чаще и быстрее.
В 2018 году появились новые возможности: из средств субсидии Минздрава России для научного отдела онкоиммунологии была закуплена система «Криобанк» стоимостью более 18 млн рублей, обеспечивающая хранение биоматериала в «сухой» фазе жидкого азота. Система представляет собой отдельное помещение с емкостями для хранения биологических образцов и автоматизированную систему подачи жидкого азота из специальной емкости, которая находится за пределами здания. Такая система исключает малейший риск контаминации (загрязнения микроорганизмами исходного биообразца), так как в жидком азоте могут выживать некоторые микроорганизмы, и гарантирует, что температура образца никогда не поднимется до критической. В настоящее время в биобанке хранится более 10 тысяч тщательно описанных и изученных образцов.
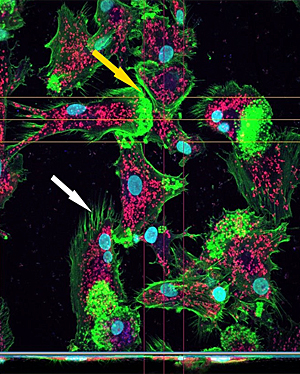
Задачи биобанкинга заключаются в обеспечении ученых биологическими образцами для активного ведения научной работы
ФУНДАМЕНТ ДЛЯ ТЕХНОЛОГИИ
Разработка и внедрение в клиническую практику новых препаратов на основе собственных клеток человека включает в себя этапы исследовательской работы с биообразцами больных. Опухоль состоит из клеток с разными молекулярно-биологическими свойствами, которые формируют ее особый профиль, уникальный для каждого пациента. В процессе прогрессирования заболевания или под воздействием предшествующего лечения опухолевые клетки постоянно изменяются, что позволяет им избегать иммунного надзора.
«Каждая опухолевая клетка имеет свой “портрет” — набор белковых молекул на поверхности клетки, на которые оказывает воздействие стандартное или экспериментальной лечение, — пояснила Татьяна Нехаева. — Любое лечение в определенный период времени приводит к изменчивости этого “портрета”. Опухолевый процесс — это хроническое заболевание, которое требует постоянного контроля за опухолевым ростом. Химиотерапия, таргетная терапия, радиотерапия, иммунотерапия оказывают воздействие на опухолевые клетки, разрушая те из них, которые проявляют наибольшую чувствительность к каждому виду лечебного воздействия. Выживают раковые клетки, которые не отвечают на цитотоксическое воздействие вследствие изменчивости». Поэтому, имея в своем распоряжении образцы биоматериала успешно пролеченных пациентов на разных стадиях лечебного воздействия, специалисты могут разрабатывать индивидуальный план лечения нового пациента.
Использование собственных клеток пациента для приготовления клеточных препаратов недостаточно эффективно, чтобы победить болезнь в его организме. Чтобы запустить процесс самоуничтожения опухоли, ученые ведут поиск иммуногенных антигенов — молекул, которые организм признает чужеродными и отвечает иммунной реакцией, направленной на их ликвидацию. Образцы берут из биобанка.
В России отсутствует единый нормативный акт, регулирующий деятельность биобанков биологических образцов человека, а отсутствие системного подхода усложняет работу отечественных лидеров отрасли
Так, ученые проанализировали имевшиеся в биобанке клеточные линии меланомы кожи, так как было известно, что именно этот вид рака потенциально высокочувствителен к иммунотерапии. В ходе анализа выяснилось, что иммуногенность различных клеточных линий меланомы не одинакова. Девять опухолевых клеточных линий меланомы стабильно представляют на своей поверхности иммуногенные белки (чужеродные антигены). Этими-то антигенами и нагружают собственные дендритные клетки пациента, запуская процесс уничтожения опухоли. «Метод получения вакцинного препарата универсален, но применяется для каждого пациента индивидуально, так как используются культуры дендритных клеток самого пациента», — уточнила Татьяна Нехаева. Не имея биобанка, к таким работам ученые не могли и подступиться. Задачи биобанкинга заключаются и в обеспечении ученых биологическими образцами для активного ведения научной работы. Обладание биологическими образцами, которые стали объектами научных исследований, повышает возможности НМИЦ онкологии им. Н. Н. Петрова получать гранты и (или) госзадания Министерства здравоохранения РФ, позволяет очень быстро, имея реактивы, оборудование, опыт и заинтересованность, выполнять качественные и масштабные исследования. Например, изучать скорость деления опухолевых клеток, их подвижность, миграционную способность, инвазию, ответ на лекарственные препараты, разрушение клетками иммунной системы в клеточных 2D- и 3D-моделях.
НУЖЕН ЗАКОН
Татьяна Нехаева акцентировала внимание на том, что в России отсутствует единый нормативный акт, регулирующий деятельность биобанков биологических образцов человека, а отсутствие системного подхода усложняет работу отечественных лидеров отрасли. «Каковы принципы деятельности биобанков, каков порядок их создания, должен ли быть штат у биобанков, какова специфика управления ими — отсутствие законодательного ответа на эти вопросы тормозит развитие получения универсальных клеточных продуктов, расширения линейки современных технологий, проведение доклинических и клинических исследований», — уверена эксперт. Артем Муравьев согласен с коллегой. Он сообщил, что работу над этим законом НАСБИО развернет в ближайшие два года.
